【病毒探源】武漢新型冠狀病毒的科學難題
【大紀元2020年02月04日訊】(大紀元記者吳英編譯報導)去年爆發自武漢的新型冠狀病毒,一個月之內疫情嚴峻,迄今全球科學家對它的認識依然有限。
瑞士生物技術公司SunRegen Healthcare AG首席科學官及共同創辦人董宇紅(Yuhong Dong,音譯)撰文提出武漢新型冠狀病毒的科學難題。以下是全文內容。
武漢新型冠狀病毒(2019-nCoV)的突然爆發擴散到整個中國,並且震驚全球。這個新型「病毒」具有極高的傳輸速度(基本繁殖數R0高)以及高致死率特徵,對人類構成前所未有的巨大威脅。由於目前來自中國的信息有限,科學界對這個病毒的起源、人與人之間傳播持續時間,以及受感染者的臨床管理等方面的認識存在很大差距。科學家最近發表有關該病毒的研究論文,確定它的起源與自然界的基因重組無關以及從動物傳播給人類,但是仍有多項難題待進一步探討。
新型冠狀病毒的起源似乎與自然重组無關
大多數論文指出,2019-nCoV與蝙蝠冠狀病毒的相似度為88%,與SARS的冠狀病毒的相似度為79%,與MERS則僅50%。中國疾病預防控制中心病毒病預防控制所國家生物安全重點實驗室陸柔劍(Roujian Lu)2020年1月30日在《柳葉刀》期刊發表論文說:「(自然)重組可能不是該病毒出現的原因。」
2020年1月27日,希臘一項研究分析了2019-nCoV的遺傳關係,發現「新型冠狀病毒的基因,大約五成與sarbecvirus亞屬中的其它病毒沒有密切的遺傳關係」,並且具有其它冠狀病毒所沒有的中間區段。
這些研究發現表明了2019-nCoV是一種新型的冠狀病毒,推翻了作者原來認為的2019-nCoV起源於不同冠狀病毒之間的隨機自然突變的假設(也就是說不是自然演變來的)。
患者間存在極高的遺傳一致性 證明最近才傳播給人類
2019-nCoV是一種RNA病毒,具有很高的自然突變率。陸柔劍等人在《柳葉刀》發表的論文指出:「作為一種典型的RNA病毒,冠狀病毒的平均演化速率約為每個位點每年會取代10-4個核苷酸(nucleotide),每個複製周期都會產生突變。因此,令人驚訝的是,本論文所描述的來自不同患者的2019-nCoV序列幾乎相同,序列同源性(sequence identity)超過99.9%。這一發現表明,2019-nCoV是在很短時間內自一個起源地產生,而且相對較快的被檢測到。」
上週,《科學》雜誌的一篇文章說:「病毒在人群中傳播的時間越長,就需要更多的時間來形成能夠區分感染者體內毒株的突變,並且鑑於迄今為止分析發現的2019-nCoV序列,最多只檢測出來7個核苷酸的差異,這表明它是最近才進入人體的。不過,是哪個動物將這個病毒傳播給人類,目前仍然是一個謎。」
蝙蝠或華南海鮮市場並非所有的故事
陸柔劍在《柳葉刀》期刊發表的論文還探討了新型冠狀病毒的天然宿主。「首先,該病毒疫情於2019年12月下旬首次被報導出來,當時武漢的大多數蝙蝠物種都在冬眠。其次,同時販賣各種非水生動物(包括哺乳動物)的華南海鮮市場,並沒有出售蝙蝠,也沒有發現蝙蝠蹤影。第三,2019-nCoV與其近親蝙蝠的bat-SL-CoVZC45和bat-SL-CoVZXC21間的序列同源性小於90%。因此,這兩個蝙蝠冠狀病毒序列並不是2019-nCoV的直接祖先。」
該論文作者指出,雖然2019-nCoV可能最初寄宿在蝙蝠上,但是傳遞給人類的機制目前仍是個謎。
此外,該《科學》雜誌的論文亦寫道:「雖然華南(海鮮)市場可能在傳播2019-nCoV的早期發揮了作用,但其是否為導致該病毒爆發的源頭仍有疑問。雖然兩份有關武漢市早期病例的研究,其中一份報告說在前41例中有27例,另一份的前47例中有26例,與華南(海鮮)市場有關,但多達45%的早期病例與華南(海鮮)市場無關,包括一些最早的病例。這增加了新型冠狀病毒最初有可能是從其他渠道感染到人體的可能性。」
棘突蛋白(Spike Protein)具有4個精確的突變 卻沒有影響其與人類受體的親和力
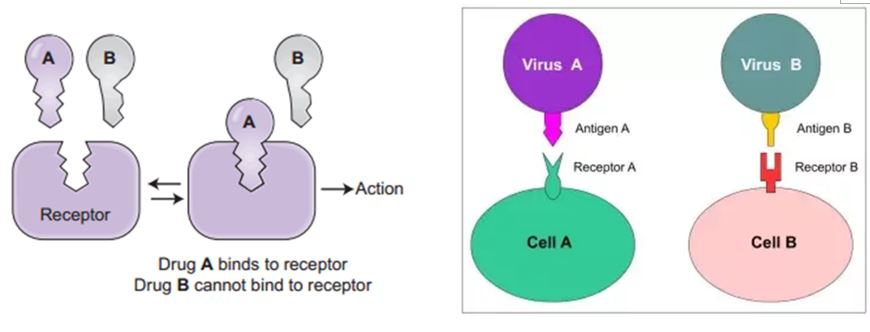
每種病毒都必須具有與人類細胞結合的受體,而且只能在人類細胞內生活以及必須依靠人類細胞進行複製。沒有這些功能,存在人體血液或組織液中的病毒很容易被人體免疫系統清除。
病毒通過特定的表面蛋白通道進入人體細胞。病毒表面蛋白與人體細胞結合的相互作用,就像使用鑰匙開鎖一樣(圖1)。
先前的研究表明,不同冠狀病毒與數個受體間的結合方式各有不同,例如SARS冠狀病毒(SARS-CoV)的血管緊張素轉化酶2(angiotensin-converting enzyme 2,簡稱ACE2)。人體組織中存在大量的ACE2受體,尤其是肺和小腸的上皮內膜,提供了SARS-CoV進入人體的途徑。
根據陸柔劍等人在《柳葉刀》雜誌上發表的論文,SARS-CoV和2019-nCoV的受體結構存在相似性。2019-nCoV的棘突蛋白(Spike Protein,S-蛋白)負責與細胞受體結合,是該病毒攻擊宿主細胞組織至關重要的成分。
該研究團隊獲得的分子模型數據表明,儘管2019-nCoV受體結合鍵中存在胺基酸突變,但是2019-nCoV仍可能使用ACE2受體進入宿主細胞。
2020年1月21日,中國科學院上海巴斯德研究所分子病毒與免疫重點實驗室研究人員在《中國科學生命科學》(SCIENCE CHINA Life Sciences),發表了一篇名為「源於武漢爆發的新型冠狀病毒的進化及其棘突蛋白對人類傳播風險的建模」(Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission)的論文,對武漢2019-nCoV的S蛋白進行了更精確的分析。以下摘自其中一段內容。
與其它冠狀病毒基因結構域相比,S蛋白通常具有最容易變化的氨基酸序列。然而,儘管武漢冠狀病毒與感染人類的SARS-CoV之間存在相當大的遺傳距離,而且總體上武漢冠狀病毒S蛋白與SARS-CoV的同源性較低,但是武漢冠狀病毒S蛋白與受體結合(RBD)場域中的序列,卻有多個片段與SARS-CoV具有高度同源性。已有研究發現,SARS-CoV S蛋白中第442、472、479、487和491位的殘基位於受體複合物界面,並且被認為是SARS-CoV跨物種及人際傳播至關重要的位點。因此,令我們驚訝的是,儘管替換了五個重要的界面胺基酸殘基中的四個,武漢CoV S蛋白被發現與人體的ACE2具有顯著的結合力,也就是在替換了武漢冠狀病毒S蛋白中442、472、479和487位的殘基位後,並沒有改變它的結構構像。武漢冠狀病毒S蛋白和SARS冠狀病毒S蛋白在RBD結構域中共享幾乎相同的3-D結構,因此在相互作用界面中保持相似的『範德華力』(van der Waals)與『靜電』(electrostatic)性質。因此,武漢冠狀病毒仍然能夠通過S蛋白與ACE2的結合途徑,對人類傳播構成重大的公共衛生風險。」
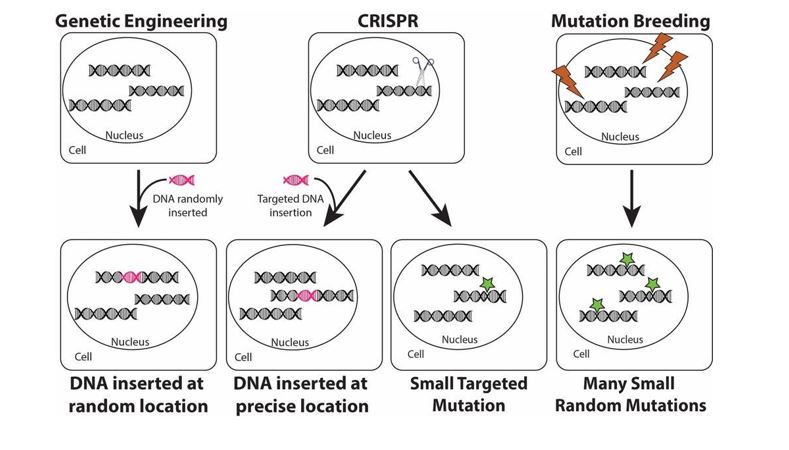
我們已經知道,2019-nCoV是不同於SARS的病毒,也知道S蛋白具有高度突變性,因此,如果2019-nCoV的S蛋白的基因序列、蛋白質結構以及功能與SARS病毒有所不同,也就不足為奇了。然而,這種新型冠狀病毒如何能聰明且精準地選擇在哪些定位點突變的同時,又能保留其對人類ACE2受體的親和力?該病毒為何可以僅改變S蛋白的四個胺基酸?又如何知道使用「常間回文重複序列叢集關聯蛋白系統」(Clustered Regularly Interspaced Short Palindromic Repeats,CRISPR-associated proteins)來確保這些動作的發生? (圖2)
令人驚訝的發現:感染艾滋病毒的S蛋白
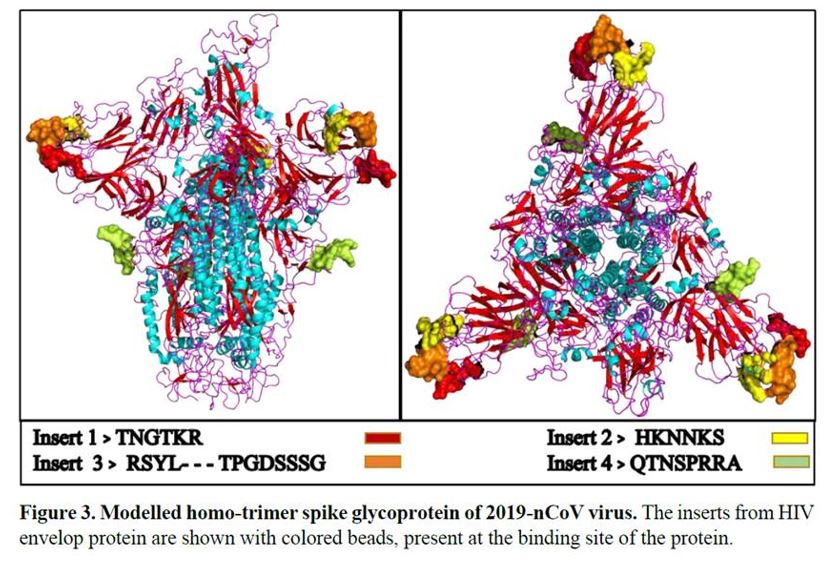
2020年1月27日,印度理工學院(Indian Institute of Technology)的普拉丹(Pradhan)教授等人發表了一篇論文:《2019-nCoV棘突蛋白中獨特插入片段與HIV-1的gp120(蛋白)和Gag(蛋白)的異常相似性》(Uncanny similarity of unique inserts in the 2019-nCoV spike protein to HIV-1 gp120 and Gag)。
作者發現在2019-nCoV的棘突醣蛋白(spike glycoprotein,S)中有4個獨一無二的插入片段(insert),「重要的是,所有4個插入體片段中的胺基酸殘基,均與HIV-1的gp120(蛋白)或HIV-1的Gag(蛋白)具有相同性或相似性。有趣的是,儘管插入片段在一級胺基酸序列上是不連續的,但是2019-nCoV的3D模型顯示它們會聚在一起構成受體結合位點。在2019-nCoV中發現的4個獨特的插入片段,這些插入片段都與HIV-1的關鍵結構蛋白中的胺基酸殘基具有同一性或相似性,這在自然界中不太可能是偶然的存在。」
普拉丹等作者補充說:「令我們驚訝的是,在SARS冠狀病毒的S蛋白或者其它冠狀病毒科的蛋白,都沒有發現這序列插入片段。這是令人震驚的發現,因為病毒不太可能在短時間內自然地獲得這種獨特的插入片段。」
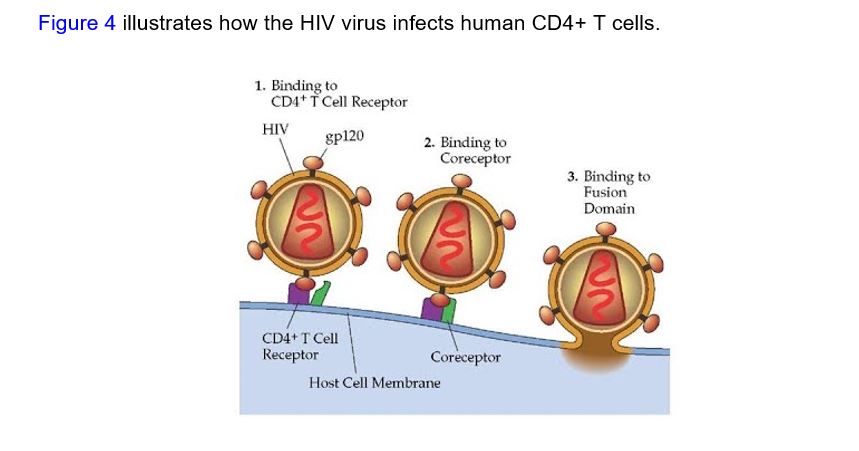
「出乎意料的是,所有插入片段都與人類免疫缺陷病毒1(HIV-1)一致。進一步的分析顯示,HIV-1與2019-nCoV的比對序列來源於表面醣蛋白gp120(胺基酸序列位置:404—409、462—467、136—150)和Gag蛋白(366—384胺基酸)。HIV的Gag蛋白與宿主細胞結合、包裝病毒以及形成病毒樣顆粒。gp120在通過與受體CD4結合識別宿主細胞的過程中起到關鍵作用,這種結合可以誘導gp120結構的重排,為驅動因子共受體(如CXCR4和/或CCR5)創建了高親和力結合位點。」
眾所周知,CD4細胞對於人類免疫是必不可少的細胞,並且是人類免疫缺陷病毒或HIV的直接目標。HIV附著在CD4細胞上,接著進入並感染它們。然後,該病毒將每個受感染的CD4細胞變成一個工廠,製造更多的HIV病毒,直到最終所有CD4細胞都被破壞。感染了艾滋病毒的人失去了免疫力或防禦系統,就像失去軍力的國家。
作者再次強調,2019-nCoV的S蛋白中被插入與HIV-1的gp120蛋白和Gag蛋白高度相似的片段是不太可能自然發生的。
該論文的作者之一昆杜(Bishwajit Kundu)教授,是專門從事蛋白質基因和基因工程研究的專家,在過去的17年中,其在PubMed上發表了約41篇論文,其中包括影響重大的生物醫學期刊。
如果我們仔細觀察一下S蛋白的4個插入片段,它們都位於蛋白的結合表面上,似乎是被設計成能夠與目標細胞受體位點結合。自然的偶然突變是隨機分布在整個長度的S蛋白上,而所有的這些插入都同時出現在S蛋白的結合位點上,這是不太可能發生的事。
臨床證據:患者發生細胞因子風暴 血液淋巴細胞逐漸下降
那麼,普拉丹等專家的發現究竟是對還是錯?如果是正確的,該新型冠狀病毒應該能夠侵入人體的CD4 T細胞並產生相應的臨床特徵。
2020年1月24日,來自武漢市金銀潭醫院的黃朝林(Chaolin Huang)教授等人在《柳葉刀》上發表的一篇文章:《中國武漢市2019年新型冠狀病毒感染患者的臨床特徵》(Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China),支持了普拉丹等人的結論。
黃教授的研究團隊分析了截至2020年1月2日確診的41名武漢肺炎病例臨床症狀。41例患者中只有27例(66%)曾去過華南海鮮市場,發病時的常見症狀為發燒(98%)、咳嗽(76%)和肌痛或疲勞(44%);較少見的症狀是多痰(28%)、頭痛(8%)、咯血(5%)和腹瀉(3%)。
呼吸困難發生率為55%(從發病到呼吸困難的中位時間為8天),63%患有淋巴細胞減少症,所有41例患者都出現肺炎症狀,胸部CT檢查發現異常。併發症包括急性呼吸窘迫綜合徵(29%)、貧血(15%)、急性心臟損傷(12%),和人傳人感染(10%)。
32%患者被送入加護病房(ICU),6名患者(15%)死亡。與非ICU患者相比,ICU患者的血漿IL2,IL7,IL10,GSCF,IP10,MCP1,MIP1A和TNFα更高。2019-nCoV感染引起嚴重的呼吸系統疾病,類似於「嚴重急性呼吸系統綜合症」(SARS)冠狀病毒,並且與ICU入院率和高死亡率有關。
儘管病毒感染中常見低白細胞數,但令人驚訝的是,63%的患者(85% ICU患者)出現淋巴細胞數減少症狀,低於1. 0 × 109/L。根據2004年一份有關SARS的研究報告,SARS患者平均淋巴細胞數通常是正常的。
2020年1月22日,中國網站發布了兩項關於武漢2019-nCoV的診斷和治療的臨床指南,其中之一是同濟醫院(Tongji Hospital)專家組撰寫的《新冠狀病毒性肺炎診斷和治療快速指南》(Quick Guide for the Diagnosis and Treatment of New Coronavirus Pneumonia),另一份則是武漢華中科技大學同濟醫學院附屬協和醫院(Wuhan Union Hospital of Tongji Medical College of Huazhong University of Science and Technology)的《2019年新冠狀病毒處理指南》(Instructions for Handling 2019 New Coronavirus)。第一份指南明確指出「淋巴細胞逐漸減少」,第二份指南強調「監視淋巴細胞絕對值的重要性」。
因此,對於一定比例的患者,觀察淋巴細胞的減少具有相當的臨床意義。CD4陽性T淋巴細胞占所有淋巴細胞的主要部分,儘管這不是對冠狀病毒感染患者的常規檢查,但監測CD4細胞計數對2019-nCoV患者可能會有幫助。
感染2019-nCoV患者的另一個臨床特徵是,血清細胞因子和趨化因子(chemokines)水平高,後者在黃教授的論文中被定義為「細胞因子風暴」(cytokine storm)。這個臨床特徵與普拉丹等人的觀察一致,即2019-nCoV S蛋白誘導GP120中的結構重排,為趨化因子共受體(如CXCR4和/或CCR5)創建了高親和力結合位點。
眾所周知,激活T細胞表面受體會引起細胞因子風暴,後者有可能對器官和身體組織造成重大損害。例如,如果肺部發生細胞因子風暴,免疫細胞(例如巨噬細胞和體液)可能會觸發組織損傷,從而導致急性呼吸窘迫並可能死亡。
雖然美國疾病控制及預防中心(CDC)網站說,對2019-nCoV感染者目前尚無特定的抗病毒治療,但是,目前已有幾例武漢2019-nCoV患者受益於洛匹那韋(lopinavir)等抗HIV藥物的治療。因此,更多此類詳細的臨床經驗應該被分享。
結論
關於這個新型冠狀病毒仍存在許多科學問題。根據最近發表的科學論文,這種新型冠狀病毒具有前所未有的病毒學特征,表明這種病毒的自然發生機率是非常罕見的。該病毒感染具有非常嚴重的臨床症狀表現,對整個人類構成了巨大的威脅。勢在必行的是,包括政府和公共衛生當局在內的世界各地的科學家、醫師和人們都必須盡一切努力調查這種可疑的病毒,以了解其起源並保護人類的未來。
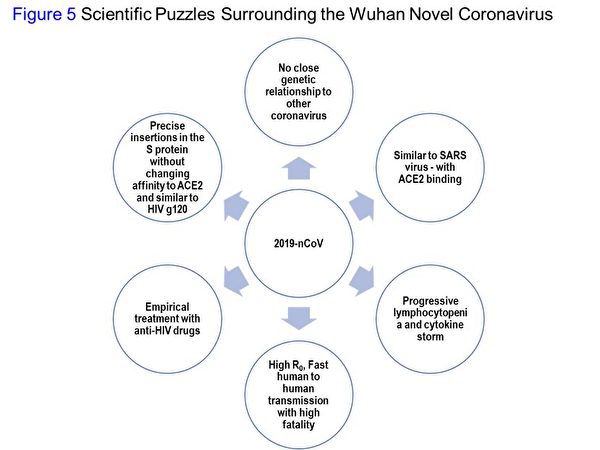
圖5所列的科學難題包括:和其它冠狀病毒沒有親近的基因關係;類似SARS,通過ACE2與人類受體結合;患者發生細胞因子風暴,血液淋巴細胞逐漸下降;高繁殖數RO,人傳人速度快,致死率高;以抗HIV藥物治療;精準地選擇在哪些定位點突變的同時,又能保留其對人類ACE2受體的親和力。
本文作者董宇紅是北京醫科大學(Beijing Medical University)醫學博士、北京大學傳染病學博士,在病毒感染性疾病臨床治療和抗病毒藥物研究方面有17年的工作經驗。她曾是北京醫科大學附屬第一醫院醫生,後來在諾華研發(Novartis Development)任抗病毒藥物臨床研究醫學專家。目前在瑞士生物技術公司SunRegen Healthcare AG擔任首席科學官。
責任編輯:林妍#
https://www.epochtimes.com/b5/20/2/3/n11842176.htm/amp
沒有留言:
發佈留言